1. Het ontwikkelen van nieuwe en innovatieve behandelmethodes die gericht zijn op remyelinisatie .
Onderzoek m.b.t. de moleculaire omgeving
Hoe kunnen we het proces van
Door het gedetailleerd bestuderen van deze processen op moleculair niveau verwachten we aanknopingspunten te vinden voor nieuwe behandelmethodes.
Vragen die we in deze onderzoekslijn willen beantwoorden zijn:
Welke moleculen in MS
Hoe kunnen we die remmende processen stoppen, zodat de remyelinisatie in de aangetaste gebieden weer op gang komt en de progressie van de ziekte wordt gestopt?
Projecten
MS en de bloed-hersenbarrière: overeenkomsten en verschillen tussen de beloopsvormen.
ONDERZOEKERS – Naomi Dijksman, Inge Zuhorn en Wia Baron
PROJECT: De ziekte multiple sclerose (MS) verloopt niet bij iedereen hetzelfde. Klinische symptomen uiten zich in een relapsing-remitting patroon (RRMS) of in een progressief beloop. Een belangrijke gebeurtenis in de vroege fase van RRMS is lekkage van de natuurlijke barrière die het bloed van de hersenen scheidt, de
Onze MSiPS Biobank vormt de basis voor dit project. In deze Biobank hebben we namelijk
Financiële bijdrage van Stichting MS Research
Project 22-1158
Het effect van steunweefsel op myelineherstel
ONDERZOEKERS – Jody de Jong en Wia Baron
PROJECT: Het
Om het effect van het steunweefsel op oligodendrocyten te bestuderen gebruiken we als uitgangsmateriaal hersenweefsel van overleden mensen met en zonder MS. Met een speciale techniek kunnen we uit de plakjes hersenweefsel de cellen wegwassen en het overblijvende weefsel, het steunweefsel dus, weer ‘opvullen’ met myeline producerende cellen of andere hersencellen die het gedrag van oligodendrocyten kunnen beïnvloeden. Hoe gaan deze cellen zich daarna gedragen? Delen ze en rijpen ze uit als ze op steunweefsel liggen van verschillende oorsprong? Verandert het steunweefsel de functie van andere hersencellen zodanig dat deze cellen oligodendrocyten negatief beïnvloeden? Maken oligodendrocyten weer myeline of juist niet?
Welke factoren belemmeren de aanmaak van nieuwe myeline? En wat vooral van belang is: kunnen we remmende factoren blokkeren of stimulerende factoren activeren? Dit alles kan leiden tot nieuwe therapieën voor MS.
Financiële bijdrage van Stichting MS Research en Monique Blom-de Wagt/Fund Girn
Project 21-1118
Nieuw doelwit om falend myelineherstel te overwinnen
ONDERZOEKERS – Jolien Fledderus, Naomi Dijksman, Rianne Gorter en Wia Baron
PROJECT:
Het ontvouwen en vouwen van fibronectine tot klonten kunnen we in celkweekmodellen nabootsen. Voorlopige bevindingen laten zien dat het
Zijn er verschillen in het chaperonne-eiwit HSP90β bij mensen met en zonder MS? Wat voor effect heeft het chaperonne-eiwit op cellen en hersenmateriaal van mensen met MS? Kunnen we in gekweekte hersenweefselplakjes waarin we het verlies van myeline en fibronectine klonten nabootsen, definitief vaststellen of het manipuleren van dit chaperonne-eiwit de ophoping van fibronectine klonten voorkomt. Het manipuleren of aanbieden van het chaperonne-eiwit met de juiste kenmerken zou dan een middel zijn om het herstel van myeline mogelijk te maken.
Ons doel is om chaperonne-eiwit HSP90β te gebruiken om de ophoping van schadelijke fibronectine klonten te voorkomen, en zodoende waardoor de voorlopercellen kunnen volgroeien tot myeline-producerende oligodendrocyten. Dit alles is erop gericht om zenuwcellen te behouden, de prikkelgeleiding te herstellen, en daarmee de progressie te beperken en mogelijk zelfs te stoppen.
Financiële bijdrage van Stichting MS Research
Project 20-1105

Het herstel van myeline dichterbij brengen: onze zoektocht naar factoren die remyelinisatie remmen
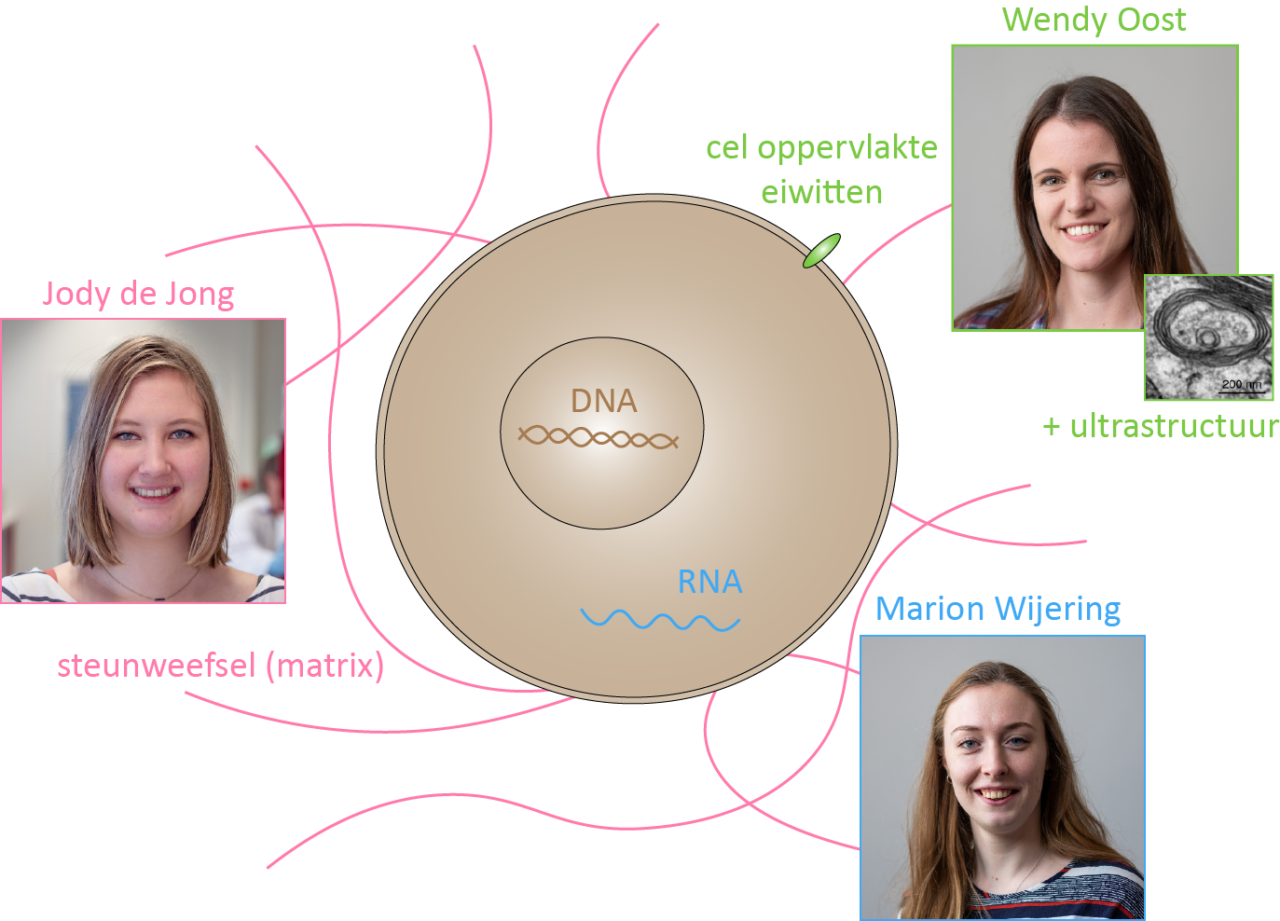
ONDERZOEKERS – Jody de Jong, Wendy Oost, Marion Wijering, Susanne Kooistra, Wia Baron en Bart Eggen.
PROJECT: Bij multiple sclerose (MS) treedt er beschadiging op van de isolatielaag (
Dit project bestaat uit 3 onderzoekslijnen, waarbij we met verschillende technieken onderzoeken welke processen en factoren een remmende werking hebben op de myeline producerende cellen en het herstel van myeline verstoren.
1. Wat gebeurt er op celniveau in de verschillende typen MS
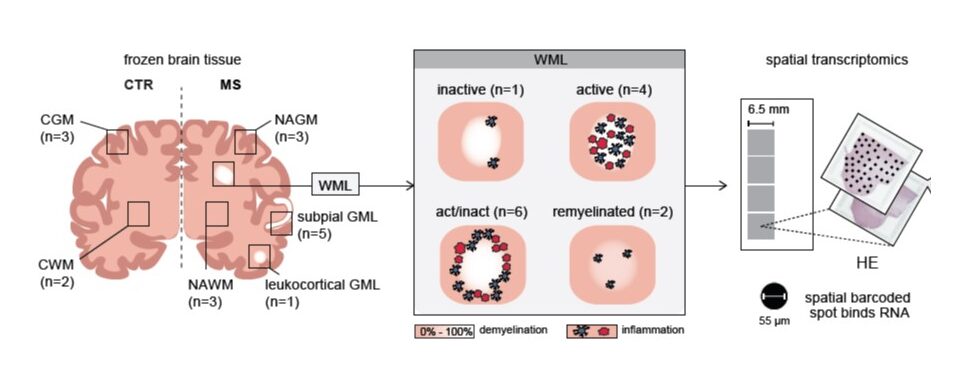
Tijdens het ziekteproces kunnen verschillende soorten laesies ontstaan, zoals actieve laesies (gebieden met veel ontstekingscellen en
Met de innovatieve techniek genaamd ‘spatial transcriptomics’ kunnen we antwoorden vinden op de volgende onderzoeksvragen: Welke celtypes vinden we in de verschillende MS-laesies en hoe wijken ze af van vergelijkbare cellen in nabijgelegen niet aangedaan hersenweefsel? En is dit anders tussen de verschillende laesie types?
2. Wat is de invloed van het omringende steunweefsel in de verschillende typen MS laesies??
Bij dit project richten we ons niet op de cellen, maar op het steunweefsel in de verschillende typen MS-laesies. Met een benadering genaamd
Welke stoffen (eiwitten) zijn aanwezig in het steunweefsel en welke invloed hebben ze op het remyelinisatieproces? En is dit anders tussen de verschillende laesie types? Kunnen we in de toekomst die eiwitten manipuleren om daarmee het remyelinisatie proces wel succesvol te laten verlopen?
3. Is er sprake van miscommunicatie tussen de cellen en hun omgeving?
In dit project willen we achterhalen of het falen van myelineherstel wordt veroorzaakt door een miscommunicatie tussen de cellen en hun omgeving met behulp van ‘celoppervlakte’ proteomics. Verder maken we met behulp van grootschalige elektronen microscopie (
Door de onderzoeksresultaten uit de 3 projecten te combineren, bepalen we welke factoren succesvolle remyelinisatie belemmeren. De verstoorde processen worden gesimuleerd in gekweekte 3D-minihersenen. Deze ‘MS-hersenen in een kweekschaal’ kunnen dan als model dienen voor het ontwikkelen en valideren van nieuwe behandelingen die remyelinisatie bij mensen met MS verbeteren.
Financiële bijdrage van Stichting MS Research
Project 18-733c
Jody, Wendy en Marion schrijven een 3-maandelijkse blog op de website van GrunnMoves over hun onderzoekservaringen. Geïnteresseerd?
De zoektocht naar remyelinisatie therapieën: verwijder het fibronectine obstakel.
ONDERZOEKERS – Rianne Gorter, Jenny Dallinga-de Jonge, Sandra Amor, Harrie Kampinga en Wia Baron
PROJECT: In het centrale zenuwstelsel van mensen met multiple sclerose (MS) raakt de myelinelaag om de uitlopers van zenuwcellen beschadigd, wat MS symptomen veroorzaakt. In ‘relapsing-remitting’ MS kunnen gespecialiseerde cellen, zogeheten ‘
Financiële bijdrage middels een MD/PhD fellowship en Monique Blom-de Wagt Grant.
Onderzoek m.b.t. de cellulaire omgeving
Hoe kunnen we het proces van
Door het gedetailleerd bestuderen van deze processen op cellulair niveau verwachten we aanknopingspunten te vinden voor nieuwe behandelmethodes.
Vragen die we in deze onderzoekslijn willen beantwoorden zijn:
Welke in MS
Hoe kunnen we een optimale cellulaire omgeving creëren om het herstelproces in MS te bevorderen?
Projecten
Wat gaat er mis tijdens de ontwikkeling van MS-laesies?
ONDERZOEKERS – Eva Geerts, Amber Woudstra, Susanne Kooistra, Wia Baron, Bart Eggen
PROJECT: Bij mensen met multiple sclerosis (MS) raakt de myelinelaag, de beschermlaag rondom de zenuwdraden, beschadigd. Uiteindelijk verdwijnt deze laag helemaal. De geleidelijke achteruitgang die mensen met MS ervaren, wordt deels veroorzaakt doordat
Om de eigenschappen van astrocyten en microglia en hun interacties beter te begrijpen, wordt de allernieuwste techniek gebruikt om cel voor cel te kijken wat er in zowel de rand als in het centrum van laesies gebeurt. Vervolgens worden
Het uiteindelijke doel van dit onderzoek is om de processen te ontrafelen en begrijpen die de groei van een laesie veroorzaken en controleren. Daarnaast onderzoeken we de processen die verantwoordelijk zijn voor de overgang van een “nog wel” naar een “niet meer” te repareren laesie. Dit onderzoek kan leiden tot nieuwe aanknopingspunten voor mogelijke medicijnen die, in combinatie met huidige ontstekingsremmers, de achteruitgang van MS écht kunnen remmen.
Financiële bijdrage van Stichting MS Research
Project 23-733e (MSCNN programmasubsidie)
Astrocyten als nieuwe therapeutische doelwitten voor MS
ONDERZOEKERS – Tamara Hageman, Susanne Kooistra, Bart Eggen, Wia Baron
PROJECT: Multiple sclerosis (MS) wordt gekenmerkt door afbraak van
Nieuwe onderzoeksresultaten wijzen uit dat dit niet komt door slecht functioneren van de cellen die het myeline maken, de
We zoeken antwoorden op de volgende vragen: Reageren astrocyten van mensen met MS anders op een ontsteking en op myelinebeschadiging dan astrocyten van mensen zonder MS? Zoals die van hun broer of zus zonder MS? Zijn de astrocyten van mensen met relapsing MS en progressieve MS verschillend? En zijn deze verschillen van invloed op het proces van myelineherstel?
In dit onderzoek maken we gebruik van de
Het uiteindelijk doel van ons onderzoek is om aangrijpingspunten, zogenaamde doelwitten, te vinden waarmee we een MS-astrocyt selectief kunnen omzetten naar een astrocyt die myelineherstel stimuleert. Dit kan als startpunt dienen voor het ontwikkelen van een therapeutisch strategie om myeline bij mensen met MS te herstellen.
Met uiteindelijke uitkomst: het stoppen van de progressie van MS.
Financiële bijdrage van het Nationaal MS Fonds

Veranderde activiteit van genen in MS.
Zijn deze genen en veranderingen relevant en kunnen ze aangewend worden als aangrijpingspunt voor therapie?
ONDERZOEKERS – Janneke Bosma, Bart Eggen, Susanne Kooistra.
PROJECT: MS is een chronische ziekte van het centrale zenuwstelsel met ontstekingsreacties, waarbij
In eerder onderzoek hebben we verschillen in gen activiteit tussen weefsels en cellen van mensen met en zonder MS in kaart gebracht. Dit heeft geleid tot een aantal uitgebreide datasets, waarin genen met veranderde activiteiten in MS geïdentificeerd zijn. Dit zouden mogelijk therapeutische aangrijpingspunten kunnen zijn. Echter, hoe deze veranderingen in gen activiteit hun weerslag hebben op het weefsel van het centraal zenuwstelsel en hoe zij bijdragen aan MS, is onduidelijk. Vervolgonderzoek, waarbij we met behulp van een nieuwe wetenschappelijke techniek specifieke cellen en locaties in een MS-laesie gedetailleerd in kaart kunnen brengen, kan hierover duidelijkheid verschaffen.
Tevens maken we gebruik van menselijke stamcellen om het gevolg van de veranderingen in
Ons uiteindelijke doel: een beperkt aantal goede kandidaten definiëren, die op basis van functionele analyses, kunnen dienen als mogelijke doelwitten voor de ontwikkeling van therapieën die effectief zijn bij progressieve MS.
Financiële bijdrage (22-1177) van Stichting MS Research
Cel-cel interacties in MS-laesies
ONDERZOEKERS – Janssen Kotah, Mirjam Koster, Susanne Kooistra en Bart Eggen.
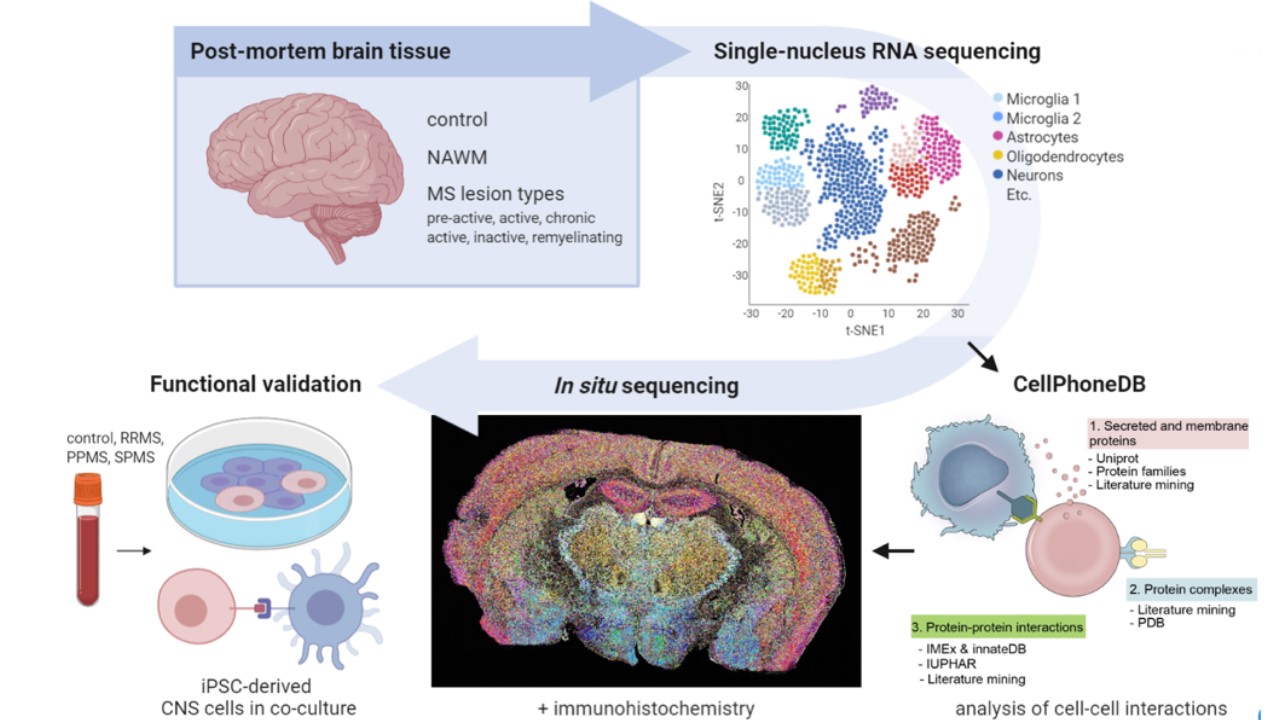
PROJECT: Bij MS wordt
Met de nieuwste technieken kunnen individuele cellen in MS-laesies in kaart gebracht worden. Hierdoor leren we meer over de veranderingen die optreden in individuele cellen bij het ontstaan en herstel van laesies. Maar de informatie wáár de cellen zich in het weefsel bevonden is hierbij verloren gegaan. De informatie omtrent cel-cel contacten en of deze cel-cel contacten verstoord zijn in een MS-laesie is daardoor ook verloren gegaan.
In dit project combineren we verschillende technieken waardoor we veranderde cel-cel interacties bij het ontstaan en de progressie van MS-laesies wel in kaart kunnen brengen.
Wat de gevolgen zijn van deze verstoorde cel-cel interacties in MS-laesies voor het functioneren van de omliggende hersencellen kunnen we daarna onderzoeken m.b.v.
Dit onderzoek leidt tot meer inzicht in hoe de verschillende hersencellen betrokken zijn bij het ontstaan en de progressie van MS-laesies.
Dit inzicht is noodzakelijk voor de identificatie van nieuwe aanknopingspunten voor de verbetering van behandelingsmogelijkheden van MS.
Financiële bijdrage van Stichting MS Research (20-1104) en dankzij een Fund Girn reisbeurs (23-1186)
Cellulaire heterogeniteit en cel-cel interacties in de ontwikkeling en progressie van MS laesies
ONDERZOEKERS – Mirjam Koster, Evelyn Wesseling, Susanne Kooistra, Bart Eggen en Wia Baron
PROJECT: MS is een ingewikkelde ziekte waarbij de pathologie aanzienlijk varieert per patiënt. Vooral het ziekteverloop, de locaties van de
Financiële bijdrage middels een GSMS PhD fellowship en financiële steun van Stichting MS Research dankzij een Fund Girn reisbeurs (23-1195).
Het immunologische geheugen van microglia
ONDERZOEKERS – Tiago Medeiros Furquim Mendonça, Amalia Dolga, Erik Boddeke, Susanne Kooistra en Bart Eggen
PROJECT: Naast adaptieve immuuncellen, kunnen aangeboren immuuncellen ook immunologisch geheugen ontwikkelen. De aangeboren immuuncellen van het centrale zenuwstelsel,
MS is een inflammatoire, neurodegeneratieve ziekte die wordt gekenmerkt door gedemyeliniseerde
Financiële bijdrage middels een GSMS PhD fellowship en financiële steun van Stichting MS Research dankzij een Young Talent Award (22-1149).